Le rôle des ultrasons dans la détection de la cardiotoxicité
Un rapport publié en 2019 par l'American Cancer Society montre qu'il y a environ 17 millions de survivants du cancer aux États-Unis.1, 2 Bien que les nouvelles thérapies anticancéreuses puissantes et ciblées soient à l'origine de cette augmentation du taux de survie, elles sont également à l'origine de l'une des principales causes de mortalité chez les patients cancéreux : les maladies cardiovasculaires induites par la thérapie anticancéreuse.3 Cet article se concentre sur l'importance d'une détection précoce et précise des dysfonctionnements cardiaques et sur la manière dont les modalités d'imagerie avancées peuvent aider les cliniciens à y parvenir.
Les conséquences à long terme du traitement du cancer sont à l'origine du domaine de la cardio-oncologie : une sous-spécialité multidisciplinaire en évolution. Elle est axée sur la détection, la surveillance et le traitement des dysfonctionnements cardiovasculaires qui surviennent comme effet secondaire de la chimiothérapie, de la radiothérapie ou d'autres thérapies potentiellement cardiotoxiques dirigées contre le cancer, tout en tenant compte des facteurs de risque individuels de développement de certaines complications cardiovasculaires (CV). Malgré l'absence d'une approche claire, fondée sur des données probantes, sur la manière de détecter, de définir ou de classer la cardiotoxicité, il existe des facteurs clés qui semblent faire l'objet d'un consensus : le temps et la précision dans l'identification de la cardiotoxicité sont cruciaux.
Une définition de la cardiotoxicité
Elle peut être définie comme toute lésion cardiaque fonctionnelle ou structurelle liée au traitement du cancer. La chimiothérapie, la radiothérapie et la thérapie ciblée peuvent toutes provoquer une cardiotoxicité et un dysfonctionnement cardiaque lié au traitement du cancer (CTRCD*). Au-delà des thérapies oncologiques, le cancer et les maladies cardiovasculaires sont liés par des mécanismes physiopathologiques complexes et des facteurs de risque communs, modifiables et non modifiables, qui peuvent accroître le potentiel de cardiotoxicité 4,5.
Cardiotoxicité : Signes, stratégies de détection et de surveillance.
Les défis posés par l'absence d'une définition universelle de la cardiotoxicité et de lignes directrices pour l'identification des CTRCD* sont évidents9. Toutefois, l'évaluation simple et largement disponible de la fraction d'éjection ventriculaire gauche (FEVG) par échocardiographie 2D ne permet souvent pas de détecter les petites modifications de la contractilité du VG. Des mesures plus précises sont disponibles en effectuant une FE volumique 3D. Mais c'est la déformation longitudinale globale (GLS) qui complète l'une ou l'autre analyse, en tant que paramètre de déformation longitudinale pour la détection précoce d'un dysfonctionnement subclinique du VG.(4)
Dans le domaine de la détection de la cardiotoxicité, beaucoup de choses ont changé depuis la reconnaissance, dans les années 1960, des effets secondaires des anthracyclines sur le dysfonctionnement cardiaque6. Plusieurs stratégies de détection de la cardiotoxicité ont été utilisées - radiographie, biopsie de l'endomètre, analyses sanguines, électrocardiogramme, échocardiogramme7 - chacune ayant ses mérites et ses limites. Les signes et symptômes de cardiotoxicité peuvent comprendre des douleurs thoraciques, des modifications du rythme cardiaque, un essoufflement et un gonflement de la cheville8. Cependant, la fonction cardiaque peut également décliner sans signe visible de cardiotoxicité et certains de ces signes peuvent n'être présents que des mois ou des années après le traitement du cancer.
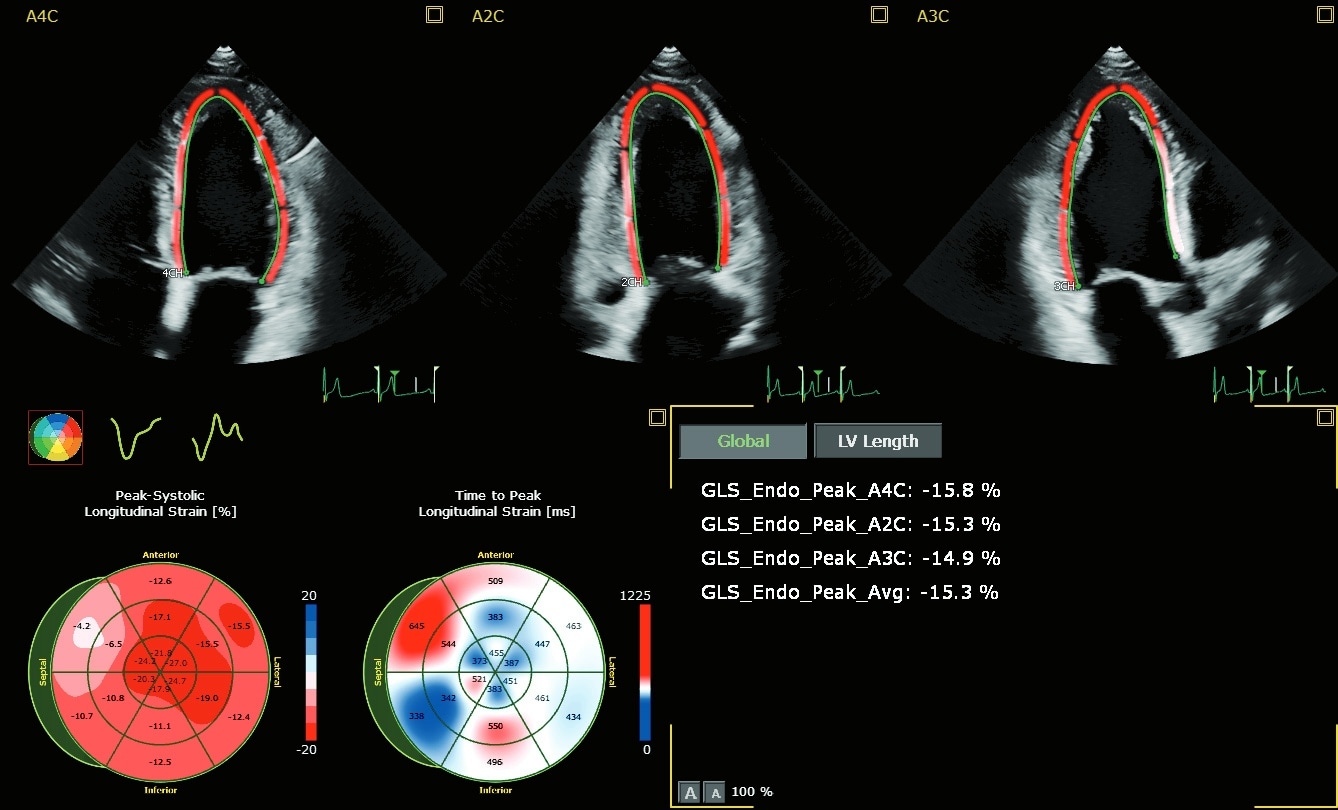
Comment détecter la cardiotoxicité : le rôle de l'échographie.
Des publications récentes 10 reconnaissent l'imagerie cardiaque avancée pour sa précision et sa reproductibilité croissantes ainsi que pour la personnalisation qu'elle offre grâce aux nouveaux biomarqueurs d'imagerie et leur potentiel à fournir des informations précieuses dans le domaine interdisciplinaire de la cardio-oncologie. Parmi ces modalités émergentes figurent l'échocardiographie 2D et 3D, la déformation longitudinale globale (GLS) et la résonance magnétique cardiaque, les biomarqueurs cardiaques et le balayage d'acquisition multidimensionnel.
La surveillance non invasive et précise de la FEVG par imagerie cardiaque "est apparue comme la stratégie la plus largement utilisée pour surveiller les modifications de la fonction cardiaque, tant pendant qu'après l'administration d'un traitement anticancéreux potentiellement cardiotoxique". 6
Pour aller plus loin :
Références *CTRCD : Cancer therapeutics–related cardiac dysfunction L’application Dynamic HeartModelA.I. est un dispositif médical de classe I fabriqué par Philips. Il est destiné à la quantification et l’analyse des données d’images et au diagnostic médical. Les actes diagnostiques sont pris en charge par les organismes d’assurance maladie dans certaines situations. Lisez attentivement la notice d'utilisation. Février 2021.
