Cinq questions sur le rôle de l'imagerie cardiaque dans la détection précoce de la cardiotoxicité due aux thérapies anticancéreuses
Nous avons parlé avec le Dr Teresa López-Fernández de la manière dont l'échographie cardiaque peut aider les cliniciens dans la détection, la gestion et le suivi des patients en cardio-oncologie.
Quelles sont les modalités utilisées pour détecter, gérer et suivre les patients en cardio-oncologie ?
Actuellement, l'écho est considérée comme la méthode de choix pour évaluer la fonction ventriculaire chez les patients cancéreux en raison de sa grande disponibilité et de son coût, plus accessible. L'utilisation de l'échocardiographie a été associée à une plus grande utilisation de médicaments cardioprotecteurs, peut-être en raison d'une détection plus précoce de la cardiotoxicité. La CMR est recommandée lorsque les résultats de l'échographie sont jugés peu fiables et chez certains patients à haut risque3,4.
Dr. Teresa López-Fernández : La cardiotoxicité comprend neuf grandes catégories de complications CV*, l'insuffisance cardiaque étant la plus répandue de nos jours. Dans ce scénario, l'imagerie cardiaque joue un rôle essentiel tant du point de vue du diagnostic que du pronostic. La surveillance et le diagnostic des dysfonctionnements cardiaques liés au traitement du cancer (CTRCD*) reposent sur des paramètres cliniques, des biomarqueurs et des paramètres d'imagerie cardiaque en série, afin d'identifier les patients présentant un risque d'insuffisance cardiaque1,2. Les modalités d'imagerie choisies pour la surveillance cardiaque dépendront du scénario clinique ainsi que de l'accès et de l'expertise au niveau local. L'échographie et l'imagerie par résonance magnétique (IRM) cardiaque sont les techniques les plus plébiscitées pour surveiller le traitement du cancer car, elles fournissent des informations complètes et sans radiation sur la fonction cardiaque globale.
* Insuffisance cardiaque, hypertension, arythmies cardiaques, coronaropathie, maladie vasculaire périphérique, hypertension pulmonaire, cardiopathie valvulaire et maladies péricardiques.
Quelle est la fréquence d'utilisation de l'échographie avancée ?
Par conséquent, la méthode du biplan de Simpson est le paramètre le plus couramment utilisé pour le suivi des CTRCD* et les nouveaux paramètres d'écho et de déformation 3D sont limités aux centres universitaires, avec les cliniques de cardio-oncologie6,7. Malheureusement, la surveillance CTRCD* exclusivement basée sur la fraction d'éjection ventriculaire gauche (FEVG) par échocardiographie 2D n'est pas assez sensible pour détecter les premiers stades de dysfonctionnement myocardique, essentiellement parce que la variabilité intra-technique (8-11 %) est parfois supérieure au seuil utilisé pour définir la cardiotoxicité 3,4,8. En outre, les pratiques de prescription de l'imagerie ont été dictées par le régime de chimiothérapie plutôt que par le risque individuel d'événements cardiaques indésirables majeurs. L'objectif global de l'échosurveillance étant de déterminer correctement le stade B de l'insuffisance cardiaque9, il est recommandé d'utiliser des paramètres plus sensibles et reproductibles comme l'écho 3D et l'imagerie des déformations du myocarde pour identifier les patients à risque d'insuffisance cardiaque afin de pouvoir lancer des thérapies modernes 10,11,12.
Dr. Teresa López-Fernández : De nos jours, en Europe, la plupart des patients sont examinés dans des structures de cardiologie générale et il existe un faible pourcentage de structures cardio-oncologiques plus importantes5.
Quel est le rôle de l'échocardiographie dans la gestion et le suivi des patients en cardio-oncologie ?
Dr. Teresa López-Fernández: Nous utilisons l'écho pour stratifier le risque des patients avant le traitement du cancer, pour identifier les lésions cardiovasculaires, pour prédire la guérison des blessures et pour détecter les lésions cardiaques chez les survivants du cancer à long terme17. Pour améliorer l'intégration de l'échocardiographie dans la cardio-oncologie, nous sommes confrontés à trois grands défis. Premièrement, nous avons besoin d'outils d'échographie avancés qui fonctionneront chez un grand nombre de patients (implications en termes de temps, de coûts et de disponibilité) présentant différents profils de cardiotoxicité ou de risques attendus. Deuxièmement, nous devons être conscients que les oncologues ne sont pas des experts en imagerie cardiaque et que nous devons donc traduire les données en conclusions claires, afin d'aider à la prise de décision clinique. Troisièmement, le diagnostic des CTRCD* n'est pas suffisant et le travail en équipe multidisciplinaire est essentiel pour la prise de décisions complexes qui améliorent les résultats cliniques.
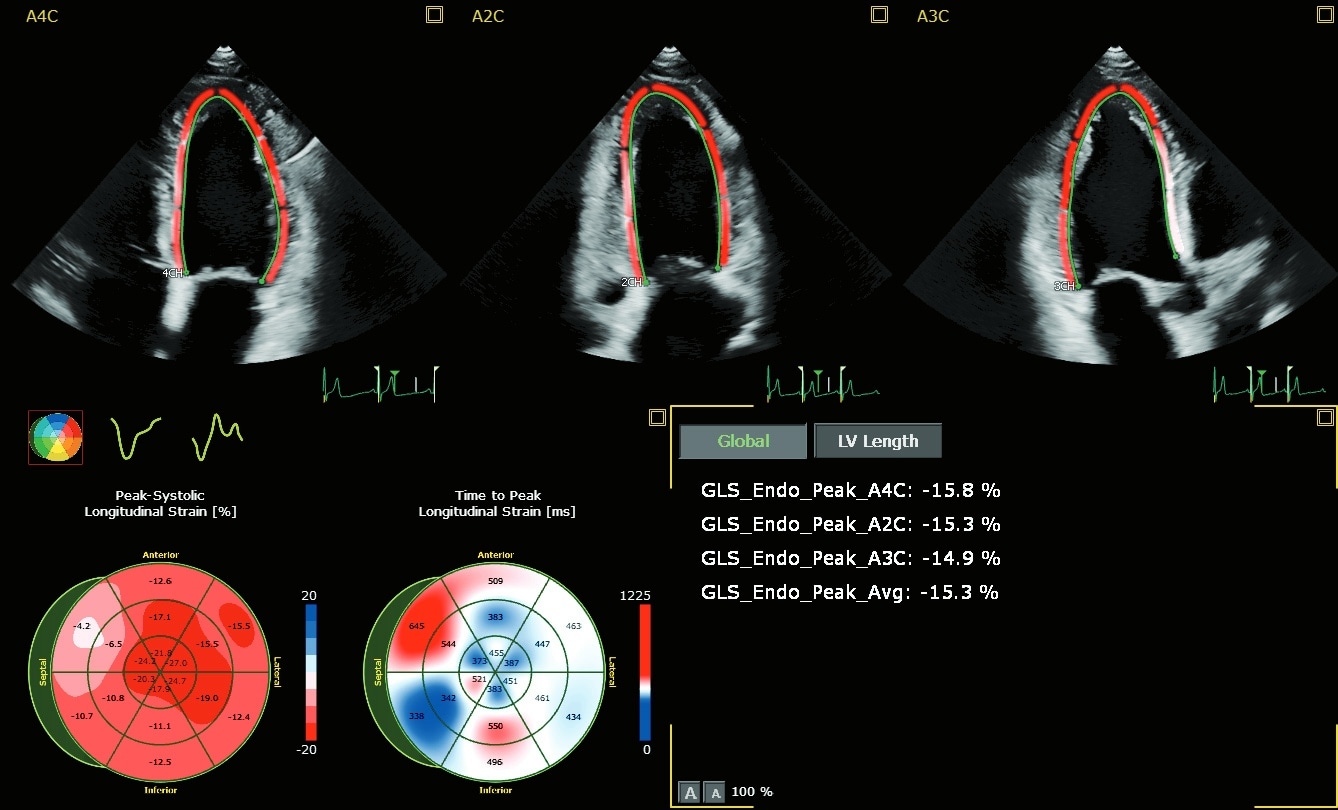
Y a-t-il un avantage à utiliser la FE volumique 3D en complément du GLS ?
Dr. Teresa López-Fernández: Le CTRCD* est un phénomène continu qui commence par une lésion des cellules myocardiques et se poursuit par un dysfonctionnement progressif du ventricule gauche qui, s'il n'est pas pris en compte et traité, conduit progressivement à une IC manifeste13. La 2D identifie trop tard la cardiotoxicité, uniquement lorsqu'une altération fonctionnelle importante est déjà survenue, ce qui exclut toute chance de prévention efficace, car plus le temps passe, plus les possibilités de guérison se réduisent.14 La 3D augmente la capacité à détecter des changements plus faibles de la FEVG par rapport à la 2D et offre une variabilité temporelle plus faible que la 2D pour le suivi longitudinal des patients subissant une chimiothérapie. La technique se compare bien à la CMR et les valeurs de FE sont identifiées par la 3D plus tôt que par la 2D chez les patients cancéreux qui développent une cardiotoxicité 3,4,15. Malgré ces avantages, le temps et l'expertise nécessaires pour analyser l'écho 3D se sont avérés être un obstacle à l'acceptation clinique à grande échelle. Pour améliorer l'intégration de la 3D dans la pratique clinique, nous avons besoin d'un logiciel de quantification entièrement automatisé, comme le Dynamic HeartModel A.I, pour à la fois réduire la courbe d'apprentissage et minimiser la consommation de temps. Une autre question importante est de savoir si la surveillance cardiaque basée uniquement sur la FE est suffisante. Comme vous le savez, le cœur a une structure hélicoïdale composée de trois couches coordonnées de fibres myocardiques et la FEVG n'évalue que la fonction radiale. La composante longitudinale de la déformation du VG est plus sensible que la 2D pour détecter la présence de maladies myocardiques précliniques dans différents scénarios cliniques, en particulier dans la population générale à risque de IC26 . Il a été démontré que la déformation longitudinale globale est une technique réalisable sans nécessiter de temps supplémentaire pour l'acquisition d'images et avec une analyse minimale en utilisant de nouvelles méthodes automatiques. La GLS a une meilleure reproductibilité que la 2D standard lorsqu'elle est réalisée par des opérateurs formés ou après une courte période de formation. En attendant les résultats de l'essai Succour,17 une stratégie de surveillance basée sur la 3D et la GLS pour identifier les changements précoces de la fonction ventriculaire et guider la thérapie cardioprotectrice semble être la meilleure stratégie chez les patients à haut risque subissant une chimiothérapie cardiotoxique.
Découvrez les images obtenues avec Dynamic HeartModelA.I.

À quelle fréquence un patient doit-il être suivi ?
"Auteur : Dr. Teresa Lopéz-Fernández. La Paz University Hospital, CIBER CV. IdiPAZ Research Institute." Les applications d'échographie cardiovasculaire de Philips visent à répondre à ces enjeux. S'appuyant sur l'intelligence anatomique et les technologies d'automatisation, Philips combine l'imagerie 3D avec des mesures GLS rapides et reproductibles, pour une meilleure précision, en moins de temps. Les examens échocardiographiques de base précis, les suivis et les évaluations des changements sont faciles à visualiser et à modifier par les experts et les nouveaux opérateurs - le tout dans la même machine, sans équipement supplémentaire. Un engagement : fournir des mesures cardiaques critiques de haute qualité en quelques secondes. Une meilleure gestion et planification des thérapies pour un plus grand nombre de patients en moins de temps afin aider les cliniciens à évaluer rapidement, en toute confiance les symptômes de cardiotoxicité et à orienter leur choix de thérapies appropriées.
Dr. Teresa López-Fernández: Les patients recevant des traitements anticancéreux doivent être considérés comme présentant un risque d'insuffisance cardiaque (insuffisance cardiaque de stade A) et la surveillance de la fonction ventriculaire gauche est recommandée pour l'identification précoce des lésions myocardiques asymptomatiques (insuffisance cardiaque de stade B)18. Avant d'administrer des traitements potentiellement cardiotoxiques, il est recommandé de procéder à un dépistage complet, y compris une évaluation par écho, afin d'exclure les problèmes cardiaques pertinents et d'optimiser la thérapie CV si nécessaire. L'écho de base est particulièrement importante pour évaluer le risque de cardiotoxicité chez les patients présentant des problèmes CV préexistants ou ayant déjà subi des traitements anticancéreux. Nous savons qu'une FEVG de base réduite ou faiblement normale (50-55%) triple presque le risque d'événements cardiaques29. Chez ces patients, dont la FEVG normale est faible, ou chez ceux qui présentent un risque cardiovasculaire plus élevé, la FEVG de base améliore encore la prédiction de l'IC20. Pendant la phase active du traitement, l'échocardiographie joue un rôle essentiel tant du point de vue du diagnostic que du pronostic. La stratégie de surveillance de l'écho dépend du schéma thérapeutique prévu et des risques encourus par les patients. La fonction ventriculaire gauche est généralement réévaluée tous les 3 à 6 mois, en cas de suspicion d'insuffisance cardiaque et à la fin du traitement1,2,21. Le dépistage en série permet une identification et une prise en charge précoces des CTRCD*. La stratégie idéale consiste à comparer les mesures 3D et GLS obtenues pendant la chimiothérapie avec celles obtenues au départ, ce qui permet au patient de servir de contrôle. Le plus fort prédicteur de CTRCD*, défini comme un dysfonctionnement subclinique du ventricule gauche, est une baisse relative de la GLS > 15 % par rapport au niveau de base1,3,14. Si les mérites de l'échocardiographie dans la détection des CTRCD* chez les patients atteints de cancer sont reconnus, il reste de réels défis à relever dans le cadre cardio-oncologique - tels que la qualité de l'image, la précision, les coûts, la disponibilité et la nécessité de former des spécialistes pour aider à la prise de décision clinique.
Pour aller plus loin :
Références L’application HeartModel est un dispositif médical de classe I fabriqué par Philips. Il est destiné à la quantification et l’analyse des données d’images et au diagnostic médical. Les actes diagnostiques sont pris en charge par les organismes d’assurance maladie dans certaines situations. Lisez attentivement la notice d'utilisation. Février 2021.
*CTRCD : Cancer therapeutics–related cardiac dysfunction
